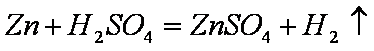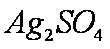- 化学反应速率的影响因素
- 共28题
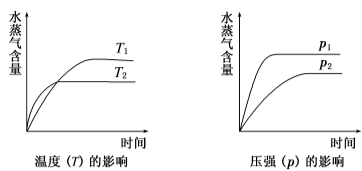
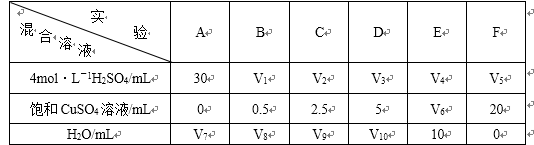
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
正确答案
解析
本题考查化学平衡知识,通过分析图象确定可能对应的反应,观察图象可知,达到平衡用的时间短反应速率快,T2>T1、p1>p2.升高温度水蒸气的百分含量降低,说明平衡逆向移动,反应放热,ΔH<0;增大压强水蒸气的百分含量增大,说明平衡正向移动,正反应气体分子数减少,综合分析A选项中反应符合要求。
知识点
已知分解lmolH2O2放出热量98 kJ.在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I—→H2O+ IO— 慢 H2O2+ IO—→H2O+O2+I—快
下列有关该反应的说法正确的是
正确答案
解析
略
知识点
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题;
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢氯生成速率的原因是
(3)实验室中现在Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集4产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为;当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
正确答案
(1)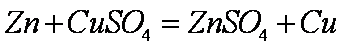
(2)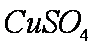
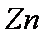
(3)
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等
(5)①30 10 17.5
②灰黑 暗红
③当加入一定量的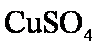
解析
(1)上述实验中发生反应的化学方程式有Zn+CuSO4==ZnSO4+Cu和Zn+H2SO4==ZnSO4+H2。
(2)由于生成了铜,因此已经构成了Zn—Cu原电池,这样便加快了氢气产生的速率。
(3)根据金属活动性顺序表,能与Zn发生置换反应的只有Ag2SO4。
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增大锌粒的表面积等。
(5)①因为生成相同体积的气体,而金属Zn是过量的,则4mol/L H2SO4的体积应相同,所以V1=V2=V3=V4=V5=30mL。又由F可知,溶液的总体积为V5+20 =30+20 =50 mL,因此V6=50 mL-10 mL-30=10 mL;V9=50 mL-2.5 mL-30 mL=17.5 mL。
②由于A中未加入饱和CuSO4溶液,则实验A中的金属呈灰黑色;而E中加入了10 mL的饱和CuSO4溶液,与金属Zn发生了反应生成了单质Cu并沉积在Zn的表面,故实验E中的金属呈暗红色。
③当加入少量CuSO4溶液时,由于构成了Zn—Cu原电池,因而生成氢气的速率会大大提高。当加入一定量的CuSO4后,生成的单质铜会沉积在Zn的表面降低了Zn与溶液接触的表面,使得氢气生成速率反而下降。
知识点
下列描述违背化学原理的是
正确答案
解析
略。
知识点
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)
正确答案
解析
略
知识点
扫码查看完整答案与解析