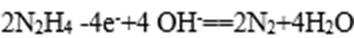- 原子结构示意图
- 共26题
下列有关化学用语表示正确的是
正确答案
解析
有关化学用语常涉及常见物质的组成和结构,尤其是一些常见物质电子式、结构式、结构简式及模型等等,内容比较基础。
知识点
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: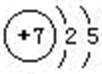
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
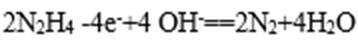
知识点
(1)元素M的离子与
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明



(填序号)。
a滴入酚酞溶液变红,再加入
b滴入酚酞溶液变红,再加入氯水后红色退去
c滴入酚酞溶液变红,在加入
(4)元素X、Y在周期表中位于同一主族,化合物

①非金属X Y(填:“<”或“<”)
②
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
正确答案
见解析。
解析
(1)写出M原子的结构示意图:
(2)Al3++3NH3H2O===Al(OH)3↓+3NH4+
(3)选C;C能证明既有反应物又有生成物。
酚酞检验OH-;A中H2SO4消耗的是OH-;B中加入氯水后红色褪去,可能是氯水直接和OH-反应。C中加入BaCl2后产生白色BaSO3沉淀,可见原体系中含有SO32-
(4)①<;
通过砖红色的Cu2Y可判断出Y是O元素(葡萄糖与菲林试剂反应生成砖红色的氧化亚铜Cu2O沉淀)
②Cu2O+6HNO3===2Cu(NO3)2+2NO2↑+3H2O
(5)温度越高,平衡常数越小。
因为从表格数据得知,D物质的量为0,平衡一定会向正方向移动,(气体体积减小)而从题干信息得知,压强升高,在恒容绝热下那一定是因为放热导致容器温度升高,从而使得压强增大,推出正方向放热。
知识点
(1)磷、硫元素的单质和化合物应用广泛。
1)磷元素的原子结构示意图是____________。
2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2=C6H6O6+2H++2I- 2S2O32-+I2=S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是_____________;表中V2=___________mL。
(2)、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
____Ce3++____H2O2+____H2O =____Ce(OH)4↓+____ _______
正确答案
见解析。
解析
1)写出P原子的结构示意图: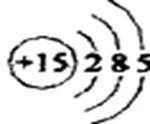
2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 
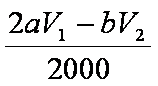
4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O= 2Ce(OH)4↓+6H+
知识点
下列有关化学用语表示正确的是
正确答案
解析
有关化学用语常涉及常见物质的组成和结构,尤其是一些常见物质电子式、结构式、结构简式及模型等等,内容比较基础。
知识点
扫码查看完整答案与解析