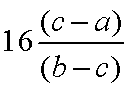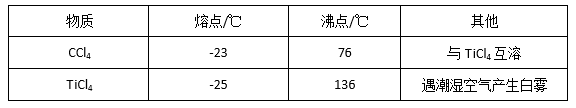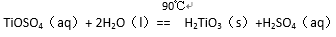- 化学实验方案的设计与评价
- 共98题
工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) 
(1)上述反应的平衡常数表达式:K =_______。
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在______溶液中PbSO4转化率较大,理由是________。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:___________;
假设三:__________。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
②定量研究:取26.7 mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:____。
正确答案
(1)
(2) Na2CO3 Na2CO3溶液中c(CO32-)较大
(3)全部为PbCO3•Pb(OH)2 PbCO3与PbCO3•Pb(OH)2的混合 物
(4)①
②同意 若全部为PbCO3,26.7 mg完全分解后,其固体质量为22.3 mg (不同意,实验最终得到固体的质量与全部为PbCO3分解所得固体质量相差不大,可能是实验过程中产生的误差引起的)
解析
略
知识点
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。
正确答案
见解析。
解析
(1)难溶的碳酸盐受热易分解为氧化物和CO2,因此MgCO3受热分解得到产物是MgO与CO2。
(2)结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;CO气体不一定完全反应,因此尾气中会有CO,可利用其可燃性采取点燃法来进行尾气处理。
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;②利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;③因Fe3+遇SCN-显红色,所以步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置B C之间添加装置E防倒吸。
知识点
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量
(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;
尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a,关闭漏斗开关 b,熄灭酒精1 c,熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 。
正确答案
见解析。
解析
(1)制备一氧化碳的化学方程式是
(2)试验中,观察到反应管中发生的现象时黑色粉末变红;尾气的主要成分是CO CO2; 实验步骤: 先通入CO一会儿后 加热后 停止加热 然后继续通入CO到玻璃管冷却为止故反应完成后,正确的操作顺序为 熄灭酒精灯2,然后关闭漏斗开关 ,最后熄灭酒精1 。
(3)acb
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g, 剩余固体全部为铜,原样品中单质铜的质量分数为 4.8÷5=0.96 ;
(5)用蒸馏水稀释浓HNO3,与一定样品反应,使样品完全反应,收集产生的NO气体,并在标况下测其体积。
要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数。设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可。反应的化学方程式为CuO+H2SO4=CuSO4+H2O
知识点
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。
和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
正确答案
见解析。
解析
(1)用硫酸和亚硫酸纳反应制取二氧化硫利用固液不加热制取气体装置,因此,选ae
(2)
解得m=18.9g
设样品质量为100g,变质的亚硫酸钠为40g,生成硫酸钠的质量为45.1g,则这时亚硫酸钠的质量分数为
(3)酸性氧化物与碱的反应。便宜,成本低;吸收慢,效率低。
(4)
知识点
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu元素的相对原子质量,同时检验氯气的氧化性。
(1)为完成上述实验,正确的连接顺序为A连_________;B连_________(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为___________________________。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是_________,对应的现象为_____________________。
(4)丙装置的c瓶中盛放的试剂为 _________,作用是___________________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:_________方案测得结果更准确。你认为不合理的方案的不足之处在___________________________。
②按测得结果更准确的方案进行计算,Cu,的相对原子质量是___________________________。
正确答案
(1)E C
(2)检验氢气的纯度,(赶走系统内空气)防止发生爆炸
(3)淀粉KI溶液 溶液变为蓝色
(4)浓硫酸 吸收H2中的H2O
(5)①甲 空气中的CO2和H2O通过D口进入U形管造成实验误差较大
②
解析
略
知识点
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
正确答案
解析
分析装置知,①小烧杯中液体与②小烧杯中挥发出来的物质反应。A项,②烧杯里浓硝酸挥发出硝酸气体,进入①烧杯,使KI被氧化生成I2,4HNO3+2KI=I2+2KNO3+2NO2↑+2H2O,I2使淀粉溶液变蓝色,A项错误;B项,浓盐酸具有强挥发性,挥发出来的氯化氢进入酚酞溶液,酸不能使酚酞溶液变色,B项正确;C项,浓氨水具有强挥发性,氨气进入氯化铝溶液,发生反应:AlCl3+3 NH3·H2O=Al(OH)3↓+3NH4Cl,产生白色沉淀,C项正确;D项,饱和氯水易挥发出来氯气,氯气遇湿润红纸条,发生反应:H2O+Cl2
知识点
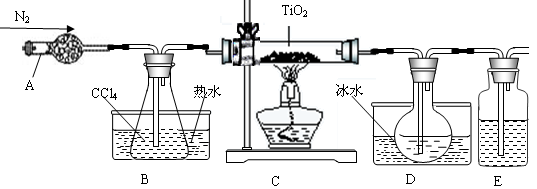
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下
有关性质如下表
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解
简要工艺流程如下:
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
正确答案
(1)干燥管;浓硫酸;检查气密性;②③①,蒸馏
(2)①铁粉,由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4·7H2O中导致TiO2产率降低。
②Fe2+,Fe2O3
解析
(1)仪器A是干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气。对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品。。。。。终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2。分离两种沸点不同的液体混合物应该用蒸馏。
(2)①因为矿石经硫酸溶解后得到的Fe2(SO4)3,而后面过滤得到的是FeSO4·7H2O,所以试剂A是铁粉,把Fe3+还原为Fe2+。由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4·7H2O中导致TiO2产率降低。
②加KSCN溶液无现象,加H2O2后出现红色,说明存在Fe2+。经加热后Fe2+氧化为Fe2O3而使产品发黄。
知识点
铜与硝酸反应的实验设计铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出右图所示装置来改进教材中“铜与硝酸的反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 ,理由是 。
(4)该小组还用上述装置进行实验,
证明氧化性KMnO4>Cl2>Br2。
① 操作步骤为 ;
② 实验现象为 ;
③ 此实验的不足之处是 。
正确答案
(1)检查装置气密性(2分)
(2)Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O(2分) 反应变缓,气体颜色变淡(2分)
(3)丙(2分) 耗酸量最少,无污染 (2分)
(4)①向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 (2分)
②c中有黄绿色气体产生,d中溶液变为黄棕色(2分) ③没有处理尾气(2分)
解析
略
知识点
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
正确答案
(1)
(2)
(3)可以通过控制加酸的量,来控制气体产生的快慢;同时小试管中充满盐酸,可以起到液封的作用,防止反应剧烈时气体经漏斗冲出
(4)点燃气体,火焰呈蓝色,再用一个内壁附着有澄清石灰水的烧杯罩在火焰上,烧杯内壁的石灰水变浑浊
解析
(1)这里与一般的物质制备思路是一致的,思路是先制备CO2,再净化除杂,干燥,接着再与C在高温下反应制CO,再除去未反应完的CO2,
(4)此问答案很多可以点燃,看火焰看产物;也可以E后面再接个灼热CuO的玻璃管后面再接个放澄清石灰水的洗气瓶,看玻璃管和石灰水的现象;也可应直接用PdCl2溶液等
知识点
下列实验操作能达到目的的是
正确答案
解析
略
知识点
扫码查看完整答案与解析